Reakcja Stettera
Reakcja Stettera – reakcja chemiczna tworzenia wiązań węgiel–węgiel przez w wyniku 1,4-addycji aldehydów z α,β-nienasyconymi ketonami (w podstawowej wersji), z wykorzystaniem katalizatora nukleofilowego[1]. Podczas gdy podobna reakcja 1,2-addycji, kondensacja benzoinowa, była znana już w latach 30. XIX w., pierwszy przykład reakcji nazwanej później reakcją Stettera, został opisany dopiero w 1973 r. przez Hermanna Stettera[2]. Reakcja ta pozwala na utworzenie związków 1,4-dikarbonylowych z aldehydów oraz akceptorów Michaela. W przeciwieństwie do 1,3-dikarbonyli, które można otrzymać w reakcji kondensacji Claisena, i 1,5-dikarbonyli, które można otrzymać w reakcji Michaela, związki 1,4-dikarbonylowe są trudniejsze do otrzymania, ale są cennymi półproduktami m.in. w otrzymywaniu furanów, piroli i tiofenów w reakcji Paala-Knorra. Typowymi katalizatorami tej reakcji są sole tiazolowe i anion cyjankowy, ale w przypadkach asymetrycznej reakcji Stettera używane są sole triazolowe. Reakcja Stettera jest przykładem reakcji wprowadzającej umpolung, tj. odwrócenie polarności, ponieważ zazwyczaj elektrofilofilowy węgiel karbonylowy aldehydu zachowuje się w tym przypadku jako nukleofil.

Mechanizm[edytuj | edytuj kod]
Ponieważ reakcja Stettera zachodzi z odwróceniem polarności, aldehyd musi zostać przejściowo zamieniony z elektrofila w nukleofil[3]. Dzieje się to przez przyłączenie węgla karbonylowego do katalizatora – cyjanku lub N-heterocyklicznego karbenu, utworzonego zazwyczaj in situ z soli tiazolowej lub triazolowej i odpowiedniej zasady[1]. W obu przypadkach mechanizm jest podobny: nukleofilowy atom węgla z cyjanku lub N-heterocyklicznego karbenu przyłącza się do atomu węgla karbonylowego, co powoduje powstanie produktu pośredniego – cyjanohydryny lub tzw. produktu Breslowa – w którym były węgiel karbonylowy może być deprotonowany (cyjanohydryna) lub tworzy enolan (produkt Breslowa), w którym były węgiel karbonylowy również jest nukleofilowy. Taki związek został zaproponowany przez Ronalda Breslowa w 1958 roku jako wspólny produkt pośredni dla wszystkich reakcji katalizowanych solami tiazolowymi, w tym tiaminą, zarówno in vitro, jak i in vivo[4].

Tak utworzony synton „nukleofilowego aldehydu” może reagować na dwa sposoby. Jednym z nich jest kondensacja z kolejnym aldehydem i wytworzeniem produktu kondensacji benzoinowej, jednak ponieważ reakcja ta jest odwracalna w tych warunkach, nie przeszkadza to w zajściu wolniejszej reakcji Stettera. Wykorzystując tę odwracalność, reakcję Stettera można przeprowadzić z benzoinami zamiast z aldehydami[1]. Właściwa reakcja Stettera zachodzi przez addycję równoważnika nukleofilowego aldehydu do akceptora Michaela. Ten etap jest nieodwracalny i w następnej kolejności powstaje 1,4-dikarbonyl z odtworzeniem katalizatora.

Zakres stosowalności reakcji[edytuj | edytuj kod]
Reakcja Stettera dostarcza trudne do uzyskania innymi drogami związki 1,4-dikarbonylowe i ich pochodne. Typowe warunki pozwalają na użycie wielu różnych substratów[1]. Jako źródła anionu acylowego mogą być użyte aldehydy aromatyczne i heteroaromatyczne oraz odpowiednie benzoiny, zarówno z solami tiazolowymi, jak i cyjankiem jako katalizatorami. Aldehydy alkilowe mogą być użyte tylko z solami tiazolowymi, ponieważ cyjanek jest w tym przypadku zbyt silną zasadą, co powoduje powstawanie produktów kondensacji aldolowej. Jako akceptory Michaela mogą zostać użyte Estry α,β-nienasycone, enony, enale, nienasycone nitryle i nitrozwiązki. Co do zasady, w asymetrycznej wersji reakcji Stettera używa się węższego zakresu substratów. Natomiast w wewnątrzcząsteczkowych asymetrycznych reakcjach Stettera można używać wiele typowych akceptorów Michaela i aldehydów w niemal dowolnych kombinacjach[5]. W takiej reakcji można zastosować zarówno aldehydy aromatyczne, heteroaromatyczne, jak i alkilowe z akceptorem Michaela w tej samej cząsteczce. Odpowiednie akceptory Michaela obejmują α,β-nienasycone estry, ketony, tioestry, nitryle, amidy Weinreba oraz alkilidenomaloniany. Nitroalkeny i enale ulegają reakcjom konkurencyjnym i nie pozwalają na uzyskanie produktu reakcji Stettera[6]. Zarówno produkty z pierścieniem pięcioczłonowym[7][8], jak i sześcioczłonowym[9][10] można uzyskać z wysokimi wydajnościami i nadmiarami enancjomerycznymi; produkty z pierścieniem siedmioczłonowym nie zostały do tej pory uzyskane w ten sposób[5]. W porównaniu do reakcji wewnątrzcząsteczkowych, asymetryczne międzycząsteczkowe reakcje Stettera są mniej zbadane i opracowane zostały dla ściśle dopasowanych par akceptora Michaela i aldehydu. W jednym przypadku literaturowym użyto aldehydu alifatycznego i nitroalkenu[11].

Modyfikacje[edytuj | edytuj kod]
Od czasu odkrycia reakcji Stettera opisanych zostało wiele jej modyfikacji. W 2001 roku Jerry A. Murry, Doug E. Frantz i in. opublikowali przykład reakcji aza-Stettera między aldehydami aromatycznymi a N-acyloiminami dającej α-amidoketony[12]. N-Acyloiminy zostały w tym przypadku utworzone in situ z adduktów sulfinowych, które ulegają eliminacji do imin w warunkach zasadowych. Reakcja ta pozwala na uzyskanie dobrych wydajności (75–90%); odpowiednie benzoiny nie są w tym przypadku dobrymi substratami[12], w przeciwieństwie do bardziej typowych reakcji Stettera[1]. Autorzy wnioskują z tego, że w tym przypadku reakcja Stettera jest pod kontrolą kinetyczną, w przeciwieństwie do kontroli termodynamicznej w normalnych warunkach[12]:

Inną modyfikacją jest użycie α-ketokwasów jako prekursorów anionu acylowego. W 2005 roku została opisana reakcja wykorzystująca pirogronian sodu zamiast aldehydu; reakcji utworzenia produktu Breslowa towarzyszy dekarboksylacja[13]. W podobny sposób można użyć 1,2-diketonów: w 2011 roku ukazała się praca wykorzystująca 2,3-butadion jako źródło anionu acylowego. W warunkach opracowanych przez autorów 2,3-butanedion rozszczepia się na octan etylu oraz produkt Breslowa uczestniczący w reakcji Stettera[14]:

W tej samej pracy zademonstrowano użycie cyklicznego 1,2-diketonu jako źródła anionu acylowego w reakcji Stettera, jednocześnie dostarczającego terminalnego estru etylowego w produkcie. Reakcja jest analogiczna do tej z 2,3-butadionem, oprócz tego, że ester pozostaje w cząsteczce i nie jest produktem ubocznym[14]:
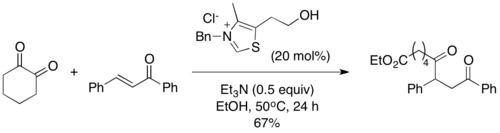
Uzyskano w ten sposób tylko estry etylowe; użycie tert-butanolu skończyło się niepowodzeniem[14].
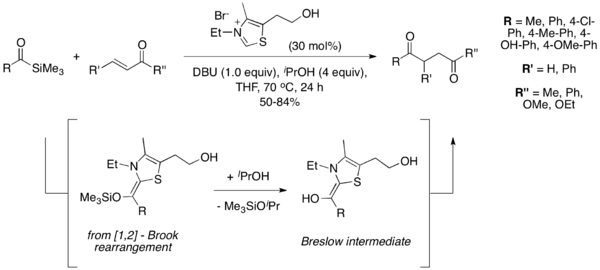
W roku 2004 Karl A. Scheidt i wsp. jak źródła anionu acylowego użył acylosilanów w reakcji Stettera. Modyfikacja ta nosi nazwę „reakcja sila-Stettera”[15]. W tych warunkach katalizator tiazolowy powoduje zajście przegrupowania [1,2]-Brooka, po którym za pomocą izopropanolu przeprowadza się desilylację, co pozwala na uzyskanie produktu Breslowa. Reakcja nie zachodzi bez dodatku alkoholu, co wskazuje na konieczność zajścia desilylacji w celu uzyskania produktu. Acylosilany są mniej elektrofilowe niż odpowiednie aldehydy, co pozwala na uniknięcie powstawania produktów reakcji benzoinowej[16].
Asymetryczna reakcja Stettera[edytuj | edytuj kod]
Pierwszy wariant asymetryczny reakcji Stettera został opublikowany w 1996 przez Endersa wykorzystując chiralny katalizator triazolowy (związek 1 na ilustracji poniżej)[17]. W późniejszych publikacjach zostały opisane kolejne katalizatory asymetrycznej reakcji Stettera, takie jak 2[18], 3[19], i 4[20]:

Szczególnie wartościowy okazał się katalizator Rovisa 2. W dalszej kolejności autorzy modyfikowali reszty arylowe zachowując szkielet aminoindanolu, co pozwoliło im na przeprowadzenie enancjoselektywnej wewnątrzcząsteczkowej reakcji Stettera tworzącej czwartorzędowe centrum stereogeniczne z aldehydami aromatycznymi jako substratami[21]. Dalsze prace pozwoliły również na użycie aldehydów alkilowych[22]. Dokładniejsze badania pozwoliły na ustalenie, że geometria substratu decyduje o diasteroselektywności, natomiast od użytego katalizatora zależy enancjoselektywność reakcji. W pierwszej kolejności następuje ustalenie konfiguracji węgla β z akceptora Michaela (przez addycję nukleofilowego aldehydu), a następnie węgla α (przez diastereoselektywne protonowanie powstałego anionu)[23]:

Nieodłączne trudności z kontrolą enancjoselektywności w międzycząsteczkowej reakcji Stettera sprawiają, że opracowywanie warunków tego wariantu reakcji pozostaje dużym wyzwaniem. Podczas gdy pewne ograniczone nadmiary enancjomeryczne zostały uzyskane przez Endersa w latach 90. dla reakcji n-butanalu z chalkonem[24], syntetycznie użyteczne warunki reakcji nie zostały uzyskane aż do 2008 roku. Grupa Dietera Endersa opisała wówczas użycie katalizatora triazolowego w reakcji aldehydów aromatycznych z chalkonami, uzyskując umiarkowane wydajności[25]. W tym samym czasie ukazała się publikacja grupy Tomislava Rovisa, opisująca sprzęganie glioksamidu z alkilidenomalonianami w obecności katalizatora triazolowego, z wysokimi wydajnościami[26]:

Rovis i wsp. zbadali następnie asymetryczną międzycząsteczkową reakcję Stettera aldehydów heterocyklicznych i nitroalkenów[27]. Podczas optymalizacji tej reakcji okazało się, że najwyższą enancjoselektywność zapewnia katalizator z podstawnikiem fluorowym. Autorzy sugerują, że pomaga on usztywnić konformację katalizatora w taki sposób, który zwiększa enancjoselektywność. Badania obliczeniowe wskazują, że większy nadmiary enancjomeryczy jest efektem oddziaływania między częściowym ładunkiem dodatnim wiązania C−F i powstającym podczas reakcji ładunkiem ujemnym na nitroalkenie[28].

Innym przykładem asymetrycznej reakcji Stettera jest enancjoselektywna synteza α-aminokwasów z wykorzystaniem N-acylamidoakrylanu jako akceptora Michaela[11]:

Zastosowania[edytuj | edytuj kod]
Reakcja Stettera jest użytecznym narzędziem w syntezie organicznej. Produkty tej reakcji, związki 1,4-dikarbonylowe, mogą być wprowadzane do bardziej złożonych związków. W jednym z zastosowań Trost użył reakcji Stettera w syntezie totalnej produktu naturalnego, racemicznego kwasu hirsutowego C. Wewnątrzcząsteczkowe sprzęganie aldehydu alifatycznego z α,β-nienasyconym estrem pozwoliło na otrzymanie tricyklicznego 1,4-dikarbonylu z wydajnością 67%. W siedmiu kolejnych etapach przekształcono ten związek w kwas hirsutowy C[29]:

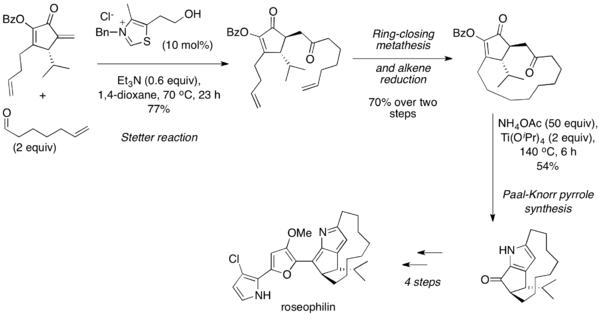
Reakcja Stettera jest często wykorzystywana do syntezy substratów do syntezy Paala-Knorra, takich jak furany, tiofeny i pirole. W 2001 roku Marcus A. Tius zaprezentował asymetryczną syntezę totalną roseofiliny, wykorzystującą wewnątrzcząsteczkową reakcję Stettera[30]. Dalsza reakcja metatezy olefin i redukcja alkenu pozwoliła na uzyskanie 1,4-dikarbonylu będącego substratem reakcji Paala-Knorra prowadzącej do pirolu. Kolejne przekształcenia pozwoliły na uzyskanie roseofiliny:
W 2004 roku została zaprezentowana sekwencja reakcji one-pot (tj. bez izolowania produktów pośrednich): sprzęgania z kompleksami palladu – izomeryzacja – reakcja Stettera – reakcja Paala-Knorra[31]. W pierwszej kolejności zachodzi sprzęganie halogenków arylowych z alkoholami propargilowymi, co daje α,β-nienasycone ketony. Te enony ulegają reakcji Stettera z aldehydami, natomiast w odpowiednich warunkach produkt 1,4-dikarbonylowy ulega reakcji Paala-Knorra do furanu lub pirolu.

Cheng Ma i wsp. opracowali alternatywną metodę syntezy furanów z wykorzystaniem reakcji Stettera[32]. W ich podejściu 3-aminofurany powstają w warunkach reakcji Stettera między aldehydami aromatycznymi i dimetyloacetylenodikarboksylanem, gdzie karben tiazolowy jest hydrolizowany równocześnie z aromatyzacją produktu do furanu. Ponieważ pierścień tiazolowy ulega w tym przypadku rozkładowi, reakcja nie jest katalityczna i sól tiazolowa musi być użyta w ilościach stechiometrycznych:
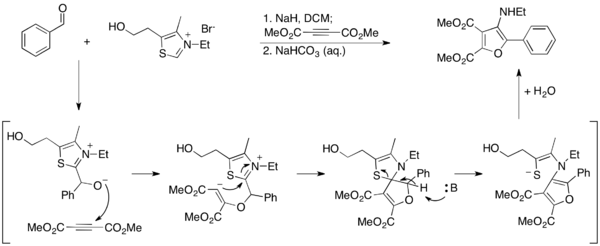
Dalsze prace w tym kierunku pozwoliły na uzyskanie 2-aminofuranów przez reakcję wykorzystującą nitryle[33]. W tym przypadku sól tiazolowa jest zastosowana w ilościach katalitycznych:

Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e Hermann Stetter, Catalyzed Addition of Aldehydes to Activated Double Bonds?A New Synthetic Approach, „Angewandte Chemie International Edition in English”, 15 (11), 1976, s. 639–647, DOI: 10.1002/anie.197606391 (ang.).
- ↑ Hermann Stetter, Manfred Schreckenberg, A New Method for Addition of Aldehydes to Activated Double Bonds, „Angewandte Chemie International Edition in English”, 12 (1), 1973, s. 81–81, DOI: 10.1002/anie.197300811 (ang.).
- ↑ J. Donald Albright, Reactions of acyl anion equivalents derived from cyanohydrins, protected cyanohydrins and α-dialkylaminonitriles, „Tetrahedron”, 39 (20), 1983, s. 3207–3233, DOI: 10.1016/S0040-4020(01)91568-6 (ang.).
- ↑ Ronald Breslow, On the Mechanism of Thiamine Action. IV.1 Evidence from Studies on Model Systems, „Journal of the American Chemical Society”, 80 (14), 1958, s. 3719–3726, DOI: 10.1021/ja01547a064 (ang.).
- ↑ a b Javier Read de Alaniz i inni, Scope of the Asymmetric Intramolecular Stetter Reaction Catalyzed by Chiral Nucleophilic Triazolinylidene Carbenes, „Journal of Organic Chemistry”, 73 (6), 2008, s. 2033–2040, DOI: 10.1021/jo702313f, PMID: 18302407, PMCID: PMC4222522 (ang.).
- ↑ Mark S. Kerr, Tomislav Rovis, Effect of the Michael Acceptor in the Asymmetric Intramolecular Stetter Reaction, „Synlett”, 2003 (12), 2003, s. 1934–1936, DOI: 10.1055/s-2003-41458 (ang.).
- ↑ Mark S. Kerr, Tomislav Rovis, Enantioselective Synthesis of Quaternary Stereocenters via a Catalytic Asymmetric Stetter Reaction, „Journal of the American Chemical Society”, 126 (29), 2004, s. 8876–8877, DOI: 10.1021/ja047644h.
- ↑ Qin Liu, Tomislav Rovis, Enantioselective Synthesis of Hydrobenzofuranones Using an Asymmetric Desymmetrizing Intramolecular Stetter Reaction of Cyclohexadienones, „Organic Process Research & Development”, 11 (3), 2007, s. 598–604, DOI: 10.1021/op600278f, PMID: 19603085, PMCID: PMC2709411 (ang.).
- ↑ Mark S. Kerr, Javier Read de Alaniz, Tomislav Rovis, A Highly Enantioselective Catalytic Intramolecular Stetter Reaction, „Journal of the American Chemical Society”, 124 (35), 2002, s. 10298–10299, DOI: 10.1021/ja027411v (ang.).
- ↑ Taiju Nakamura i inni, A Facile Synthesis of Chroman-4-ones and 2,3-Dihydroquinolin-4-ones with Quaternary Carbon Using Intramolecular Stetter Reaction Catalyzed by Thiazolium Salt, „Synlett”, 2005 (01), 2005, s. 155–157, DOI: 10.1055/s-2004-835666 (ang.).
- ↑ a b Thierry Jousseaume, Nathalie E. Wurz, Frank Glorius, Highly Enantioselective Synthesis of α-Amino Acid Derivatives by an NHC-Catalyzed Intermolecular Stetter Reaction, „Angewandte Chemie International Edition”, 50 (6), 2011, s. 1410–1414, DOI: 10.1002/anie.201006548 (ang.).
- ↑ a b c Jerry A. Murry i inni, Synthesis of α-Amido Ketones via Organic Catalysis: Thiazolium-Catalyzed Cross-Coupling of Aldehydes with Acylimines, „Journal of the American Chemical Society”, 123 (39), 2001, s. 9696–9697, DOI: 10.1021/ja0165943, PMID: 11572700 (ang.).
- ↑ Michael C. Myers i inni, Catalytic Conjugate Additions of Carbonyl Anions under Neutral Aqueous Conditions, „Journal of the American Chemical Society”, 127 (42), 2005, s. 14675–14680, DOI: 10.1021/ja0520161, PMID: 16231921 (ang.).
- ↑ a b c Olga Bortolini i inni, Thiazolium-catalyzed intermolecular Stetter reaction of linear and cyclic alkyl α-diketones, „Organic & Biomolecular Chemistry”, 9 (24), 2011, s. 8437, DOI: 10.1039/c1ob06480k (ang.).
- ↑ Anita E. Mattson, Ashwin R. Bharadwaj, Karl A. Scheidt, The Thiazolium-Catalyzed Sila-Stetter Reaction: Conjugate Addition of Acylsilanes to Unsaturated Esters and Ketones, „Journal of the American Chemical Society”, 126 (8), 2004, s. 2314–2315, DOI: 10.1021/ja0318380, PMID: 14982429 (ang.).
- ↑ Anita E. Mattson i inni, Thiazolium-Catalyzed Additions of Acylsilanes: A General Strategy for Acyl Anion Addition Reactions, „Journal of Organic Chemistry”, 71 (15), 2006, s. 5715–5724, DOI: 10.1021/jo060699c, PMID: 16839153 (ang.).
- ↑ Dieter Enders i inni, The First Asymmetric IntramolecularStetter Reaction. Preliminary Communication, „Helvetica Chimica Acta”, 79 (7), 1996, s. 1899–1902, DOI: 10.1002/hlca.19960790712 (ang.).
- ↑ Mark S. Kerr, Javier Read de Alaniz, Tomislav Rovis, A Highly Enantioselective Catalytic Intramolecular Stetter Reaction, „Journal of the American Chemical Society”, 124 (35), 2002, s. 10298–10299, DOI: 10.1021/ja027411v, PMID: 12197730 (ang.).
- ↑ Jens Pesch, Klaus Harms, Thorsten Bach, Preparation of Axially ChiralN,N′-Diarylimidazolium andN-Arylthiazolium Salts and Evaluation of Their Catalytic Potential in the Benzoin and in the Intramolecular Stetter Reactions, „European Journal of Organic Chemistry”, 2004 (9), 2004, s. 2025–2035, DOI: 10.1002/ejoc.200300762 (ang.).
- ↑ Steven M. Mennen i inni, A peptide-catalyzed asymmetric Stetter reaction, „Chemical Communications” (2), 2005, s. 195–197, DOI: 10.1039/B414574G, PMID: 15724183 (ang.).
- ↑ Mark S. Kerr, Tomislav Rovis, Enantioselective Synthesis of Quaternary Stereocenters via a Catalytic Asymmetric Stetter Reaction, „Journal of the American Chemical Society”, 126 (29), 2004, s. 8876–8877, DOI: 10.1021/ja047644h, PMID: 15264801 (ang.).
- ↑ Jennifer L. Moore, Mark S. Kerr, Tomislav Rovis, Enantioselective formation of quaternary stereocenters using the catalytic intramolecular Stetter reaction, „Tetrahedron”, 62 (49), 2006, s. 11477–11482, DOI: 10.1016/j.tet.2006.06.042 (ang.).
- ↑ Javier Read de Alaniz, Tomislav Rovis, A Highly Enantio- and Diastereoselective Catalytic Intramolecular Stetter Reaction, „Journal of the American Chemical Society”, 127 (17), 2005, s. 6284–6289, DOI: 10.1021/ja0425132, PMID: 15853335 (ang.).
- ↑ D. Enders, Enzymemimetic C−C and C−N Bond Formations, [w:] Eckhard Ottow, Klaus Schöllkopf, Bernd-Günter Schulz (red.), Stereoselective Synthesis. Lectures honouring Prof. Dr. Dr. h.c. Rudolf Wiechert, Berlin, Heidelberg: Springer Berlin Heidelberg, 1993, s. 63–90, DOI: 10.1007/978-3-642-78496-5_4, ISBN 978-3-642-78496-5, OCLC 840299291 (ang.).
- ↑ Dieter Enders, Jianwei Han, Alexander Henseler, Asymmetric intermolecular Stetter reactions catalyzed by a novel triazolium derived N-heterocyclic carbene, „Chemical Communications” (34), 2008, s. 3989, DOI: 10.1039/b809913h, PMID: 18758602 (ang.).
- ↑ Qin Liu, Stéphane Perreault, Tomislav Rovis, Catalytic Asymmetric Intermolecular Stetter Reaction of Glyoxamides with Alkylidenemalonates, „Journal of the American Chemical Society”, 130 (43), 2008, s. 14066–14067, DOI: 10.1021/ja805680z, PMID: 18834123, PMCID: PMC2684863 (ang.).
- ↑ Daniel A. DiRocco i inni, Catalytic Asymmetric Intermolecular Stetter Reaction of Heterocyclic Aldehydes with Nitroalkenes: Backbone Fluorination Improves Selectivity, „Journal of the American Chemical Society”, 131 (31), 2009, s. 10872–10874, DOI: 10.1021/ja904375q, PMID: 19722669, PMCID: PMC2747345 (ang.).
- ↑ Joann M. Um i inni, Quantum Mechanical Investigation of the Effect of Catalyst Fluorination in the Intermolecular Asymmetric Stetter Reaction, „Journal of the American Chemical Society”, 133 (29), 2011, s. 11249–11254, DOI: 10.1021/ja202444g, PMID: 21675770, PMCID: PMC3143204 (ang.).
- ↑ Barry M. Trost, Charles D. Shuey, Frank DiNinno, A stereocontrolled total synthesis of (±)-hirsutic acid C, „Journal of the American Chemical Society”, 101 (5), 1979, s. 1284–1285, DOI: 10.1021/ja00499a043 (ang.).
- ↑ Paul E. Harrington, Marcus A. Tius, Synthesis and Absolute Stereochemistry of Roseophilin, „Journal of the American Chemical Society”, 123 (35), 2001, s. 8509–8514, DOI: 10.1021/ja011242h, PMID: 11525658 (ang.).
- ↑ Roland U. Braun, Thomas J. Müller, Coupling-Isomerization-Stetter and Coupling-Isomerization-Stetter-Paal-Knorr Sequences – A Multicomponent Approach to Furans and Pyrroles, „Synthesis”, 2004 (14), 2004, s. 2391–2406, DOI: 10.1055/s-2004-831192 (niem.).
- ↑ Cheng Ma, Yewei Yang, Thiazolium-Mediated Multicomponent Reactions: A Facile Synthesis of 3-Aminofuran Derivatives, „Organic Letters”, 7 (7), 2005, s. 1343–1345, DOI: 10.1021/ol0501368, PMID: 15787502 (ang.).
- ↑ Peng Liu i inni, An Efficient Synthesis of 2-Aminofuran-3-carbonitriles via Cascade Stetter-γ-Ketonitrile Cyclization Reaction Catalyzed by N-Heterocyclic Carbene, „Synlett”, 2011 (08), 2011, s. 1133–1136, DOI: 10.1055/s-0030-1259945 (ang.).
